がんを取り巻く環境
1. がんについて
がんは日本においても世界においても、罹患率、死亡率が高い疾病のひとつであり、2022年には、世界で2,000万人近く※1の人が新規にがんに罹患しています。日本において、がんは、1981年より死因の第1位であり、2023年には、約38万人※2が亡くなりました。こうしたことから、依然として、がんは、人類の生命と健康にとって重大な問題です。
※1 出典:GLOBOCAN 2022 ※2 出典:厚生労働省 令和5年(2023)人口動態統計
主要死因別死亡率の年次推移(日本)

出典:厚生労働省「人口動態統計」をもとに当社にて作成
2. がんの治療
がんの治療は主に、「全身療法」と「局所療法」の2つに分けられます。全身療法には薬物療法があり、局所療法には外科的療法と放射線療法があります。
3. がん治療薬の市場
将来の世界の医薬品市場を治療領域別にみると、2028年の市場規模予測が最も大きい治療領域は、がん領域で66.2兆円に拡大すると見込まれています。がん領域は、医療が進歩する中にあっても、いまだ満たされていない医療ニーズが高く、革新的な医薬品の創薬が望まれていることから、2025年から2029年までの年平均成長率は11%~14%と、医薬品市場の成長を牽引すると見込まれています。
治療領域別での市場規模予測と成長率予測
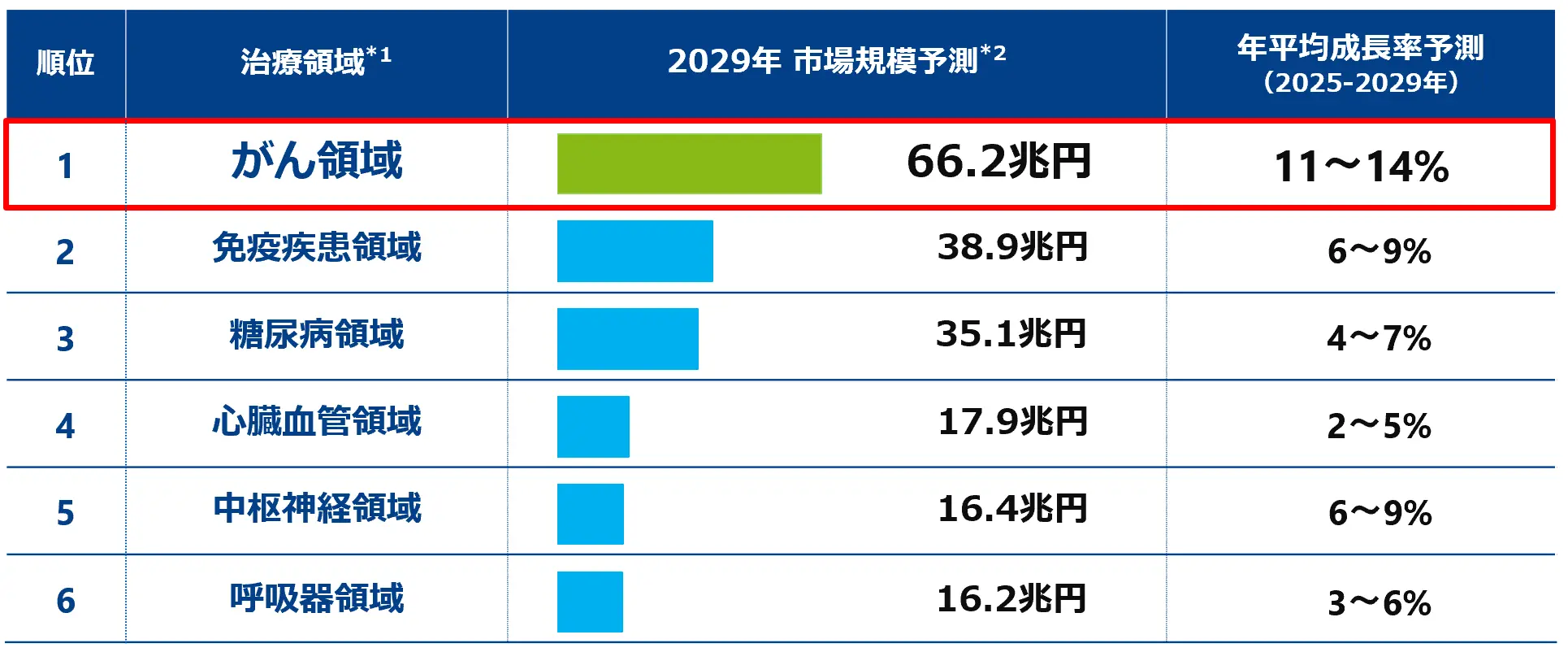
出典:IQVIA INSTITUTE, Global Use of Medicines 2024 OUTLOOK through 2029をもとに当社作成
- ※1治療領域の名称は原文では英語表記だったものを当社にて和訳しました。原文の表記は以下の通りです。
ランク1から順に、Oncology, immunology, diabetes, cardiovascular, CNS (central nervous system), respiratory
- ※2 1ドル=150円で換算
「5DXd ADCs and Next Wave」戦略
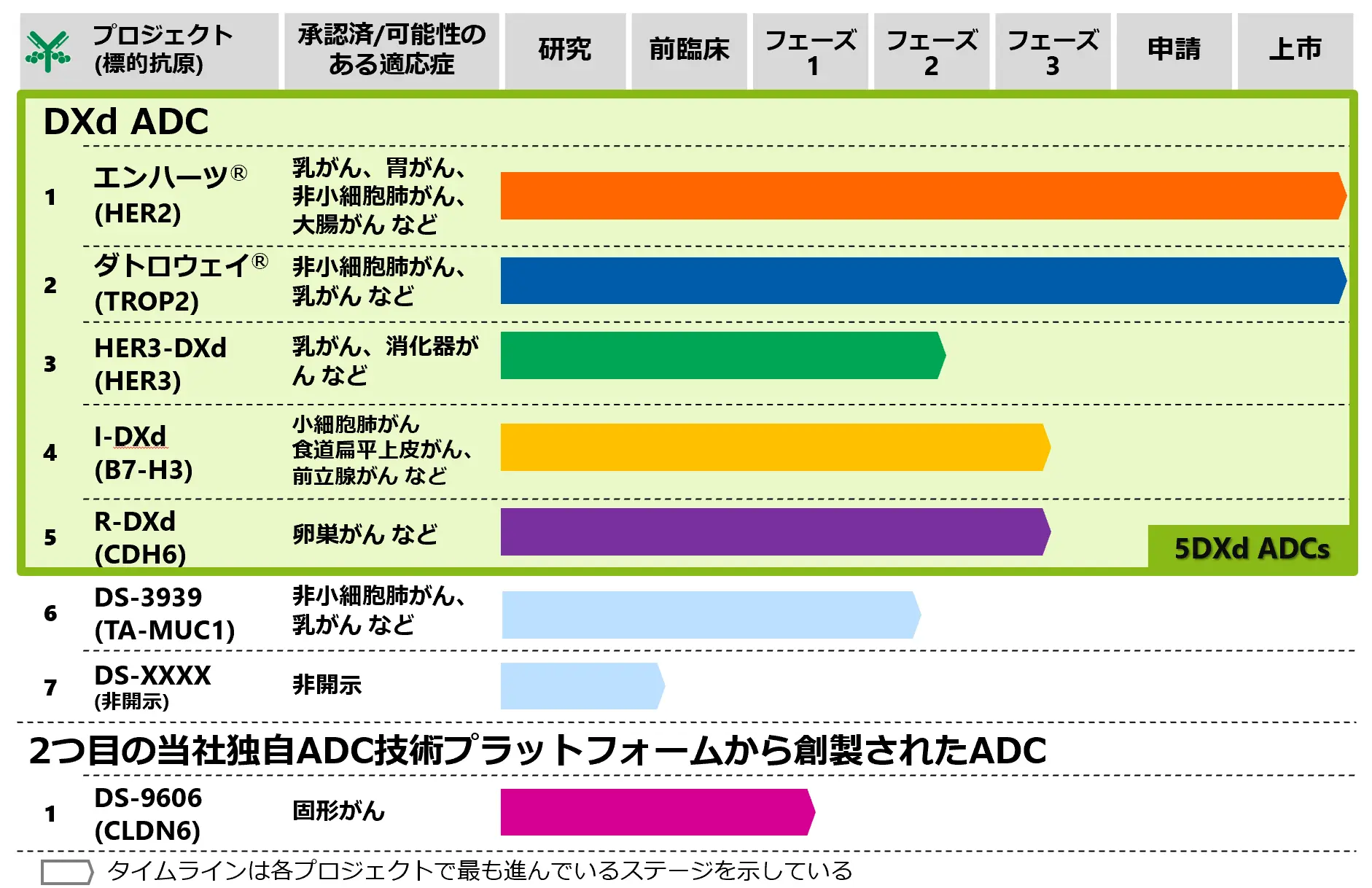
当社グループは、5つの主力抗体薬物複合体(5DXd ADCs※1)の製品価値最大化を目指してリソースを集中投入するとともに、持続的成長の実現に向けてSOC※2を変革する製品群(Next Wave)の創薬を目指す「5DXd ADCs and Next Wave」戦略のもと、研究開発に取り組んでおります。
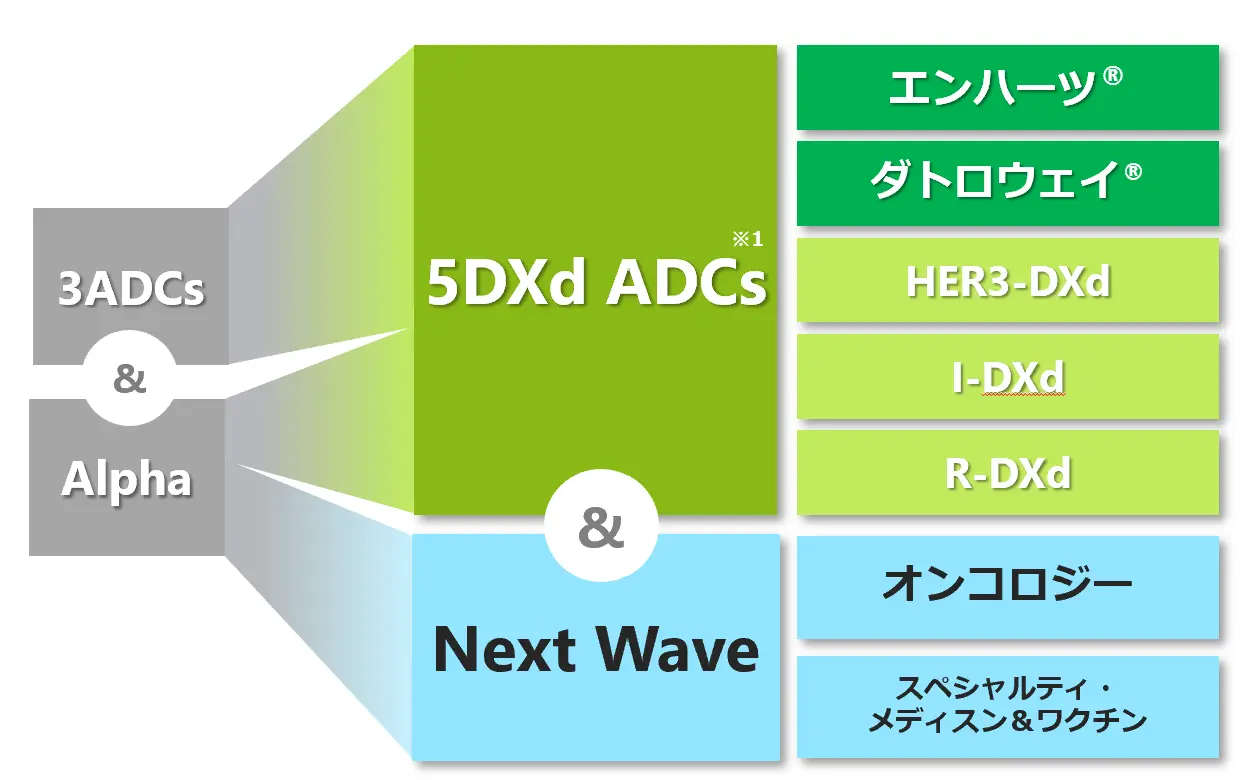
- ※1 5DXd ADCs:エンハーツ®、ダトロウェイ®、HER3-DXd、 I-DXd(DS-7300)、R-DXd (DS-6000)
- ※2 SOC(Standard of Careの略):現在の医学では最善とされ、広く用いられている治療法
(2025年5月現在)
第一三共のDXd ADC技術
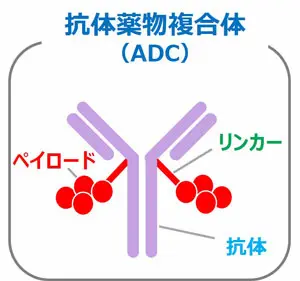
1. 抗体薬物複合体(ADC)について
ADCとはAntibody Drug Conjugate(抗体薬物複合体)の略で、抗体にリンカーと呼ばれる部分を介して化学療法剤であるペイロードを結合したものです。がん細胞を標的とする抗体に強力な化学療法剤を載せてがん細胞へ運んでもらい、がんを効果的にたたくことを狙った薬剤です。(化学療法剤と分子標的薬については、コラムに記載)
このADCのアイディアは昔からありましたが、技術的なハードルなどもあり、開発が成功し承認された薬剤はまだ少ない状況です。
化学療法剤と分子標的薬について:詳しくはこちら
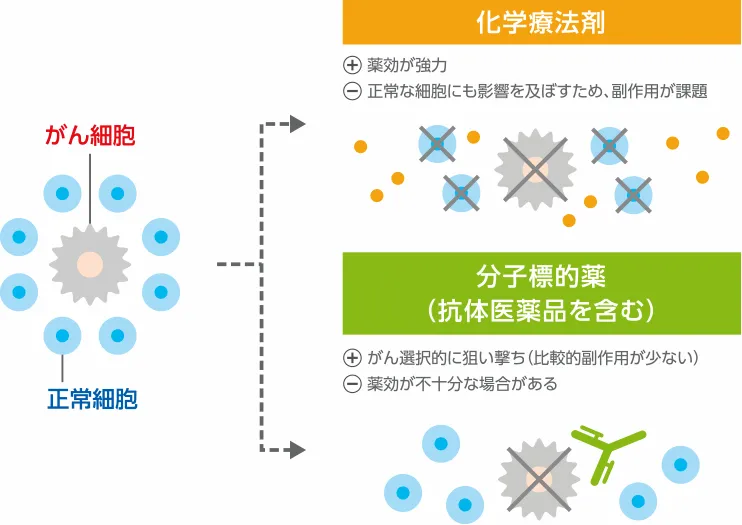
従来、がんの薬物療法の中心は化学療法剤でした。化学療法剤は、増殖の盛んな細胞に対して作用する低分子薬剤ですが、消化器や骨髄など、正常な細胞が分裂・増殖することで機能を維持する組織にも影響を及ぼすため、これが副作用となって現れます。
これに対し、分子標的薬は、がん細胞に高発現する遺伝子やタンパク質を標的とするため、正常細胞に及ぼす影響は小さく、分子標的薬独自の副作用はあるものの、従来型の化学療法剤で見られるような副作用が比較的少ないのが特長です。(抗体医薬は代表的な分子標的薬です。)
2. 第一三共のDXd ADC技術の特徴
当社独自のDXd ADC技術は、リンカーとペイロードに特徴があります。
リンカーの特徴としては、抗体1つあたり最大8個のペイロードを搭載できることで、多くの薬物をがん細胞に送り込むことができます。また、血液中での高い安定性により、薬物が、がん細胞に到達する前に放出されることを抑える一方、がん細胞内で多く発現する酵素で選択的に切断される特徴があります。
ペイロードは、新規で強力な薬剤である「DXd」で、周囲のがん細胞にも作用するバイスタンダー抗腫瘍効果を発揮し、抗体から外れた後、血液中から速やかに代謝される特徴があります。
リンカー
|
特徴1: 抗体1つあたり最大8個のペイロードを搭載可能
特徴2: 血液中での高い安定性
特徴3: がん細胞に多く発現する酵素で選択的に切断 |
ペイロード
|
特徴4: 新規ペイロード(DXd)
特徴5: 強力な活性
特徴6: バイスタンダー抗腫瘍効果
特徴7: 血液中からの速やかな代謝 |
■ 抗体薬物複合体(ADC)と第一三共のDXd ADC技術 <動画> 5分38秒
バイスタンダー抗腫瘍効果について:詳しくはこちら
がん細胞に取り込まれたペイロードが周りのがん細胞にも作用する効果です。がんは、抗原が発現しているがん細胞と、抗原が発現していないがん細胞が混在した状態にあります。標的となる抗原が発現していないがん細胞が多く混在した腫瘍に対しても、バイスタンダー抗腫瘍効果によって有効性が期待されます。
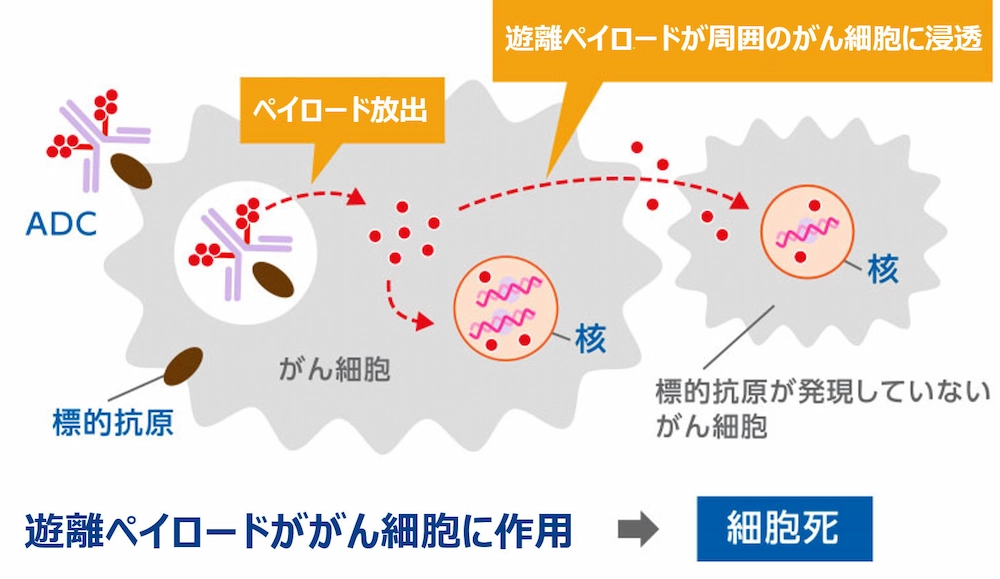
また、同じペイロードとリンカーを様々な抗体と組み合わせることで、異なる標的を狙った薬剤に展開することが可能である点もDXd ADC技術の特徴です。
3.5DXd ADCs
(各DXd ADCのイメージ図をクリックすると、それぞれの詳細説明をご覧いただけます。)

エンハーツ®
(抗HER2 ADC)

Dato-DXd
(抗TROP2 ADC)

HER3-DXd
(抗HER3 ADC)

I-DXd
(抗B7-H3 ADC)

R-DXd
(抗CDH6 ADC)
■エンハーツ®(一般名:トラスツズマブ デルクステカン)
エンハーツⓇは当社独自のDXd ADC技術を用いて創製したHER2を標的とするADCです。
本剤をより早く、より多くの患者さんに届けるため、がん領域事業において豊富な経験を持つアストラゼネカと共同開発・商業化を進めています。
■ 提携の概要
| 開発 |
・単剤・併用療法を共同開発
・開発費用を折半
|
| 販売 |
日本を除く地域 |
両社が共同販促し、損益を折半 |
| 日本 |
当社が単独販売 |
地域別の製品売上計上
・当社
日本、米国、当社が拠点を有する欧州およびその他の地域
・アストラゼネカ
中国、オーストラリア、カナダ、ロシア |
| 製造 |
当社が製品を製造、供給
|
■受領対価
契約年月
(契約時開発ステージ) |
2019年3月
(フェーズ2) |
| 契約時一時金 |
1,485億円 |
| 開発マイルストン等(最大) |
4,180億円 |
| 販売マイルストン (最大) |
1,925億円 |
| 最大総額 |
7,590億円 |
|
(1ドル=110円換算、契約締結時の為替レート水準)
|
2020年1月にHER2陽性乳がん3次治療の適応で世界に先駆け米国で発売し、その後、販売国・地域を日本、欧州、アジア・中南米などに拡大中です。
新規適応の取得も着実に進展しています。従来の標準治療薬T-DM1と比較して無増悪生存期間※1の前例のない改善を示すDESTINY‐Breast03試験の結果をもとに、2022年5月に米国においてHER2陽性乳がん2次治療の適応を取得し、販促を開始しました。その後、欧州、日本においても適応を拡大し、2023年6月に、本適応で中国において発売しました。
※1 無増悪生存期間(Progression Free Survival;PFS):治療中及び治療後に病勢進行せず安定した状態の期間
~ DESTINY‐Breast03試験結果(2022年12月、サンアントニオ乳がんシンポジウム 発表データ) ~
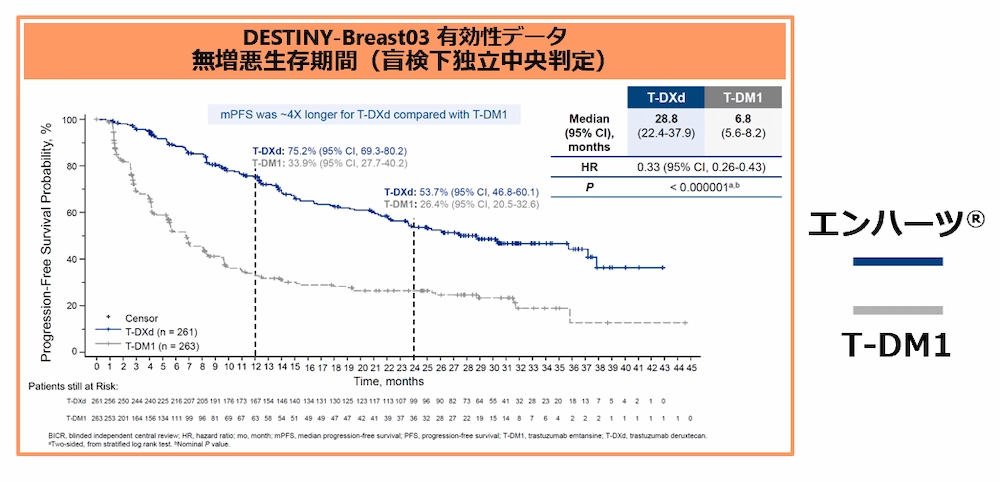
- エンハーツ®の病勢進行もしくは死亡のリスクはT-DM1と比較して67%減少 (PFSのハザード比0.33)
- 無増悪生存期間(PFS)の中央値はT-DM1の6.8ヶ月(95%信頼区間 5.6-8.2ヶ月)に対し、エンハーツ®では28.8ヶ月 (22.4-37.9ヶ月)
エンハーツ®はDESTINY‐Breast04試験においてHER2低発現乳がん患者さんの治療を変革するに値する結果を示し、HER2低発現乳がんを新たな治療セグメントとして開拓しました。
~ DESTINY‐Breast04試験結果(米国臨床腫瘍学会ASCO 2022発表データ)~
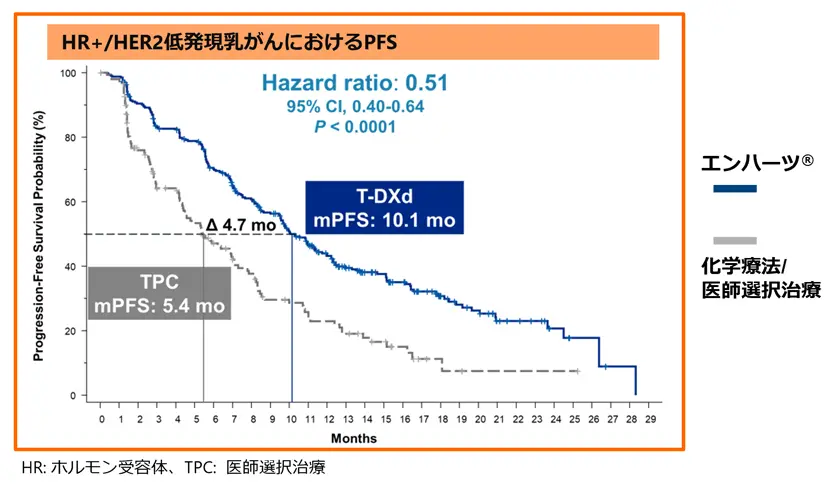
- エンハーツ®の病勢進行もしくは死亡のリスクは化学療法と比較して49%減少(PFSのハザード比0.51)
- 無増悪生存期間(PFS)の中央値は化学療法の5.4ヶ月(95%信頼区間 4.4-7.1ヶ月)に対し、エンハーツ®では10.1ヶ月(9.5-11.5ヶ月)
HER2低発現乳がんの患者数は、HER2陽性乳がんの約2倍であることが知られており、乳がん全体では約半数に相当しますが、HER2低発現はこれまでHER2陰性に分類されており、従来のHER2標的薬ではアプローチできていなかったセグメントです。
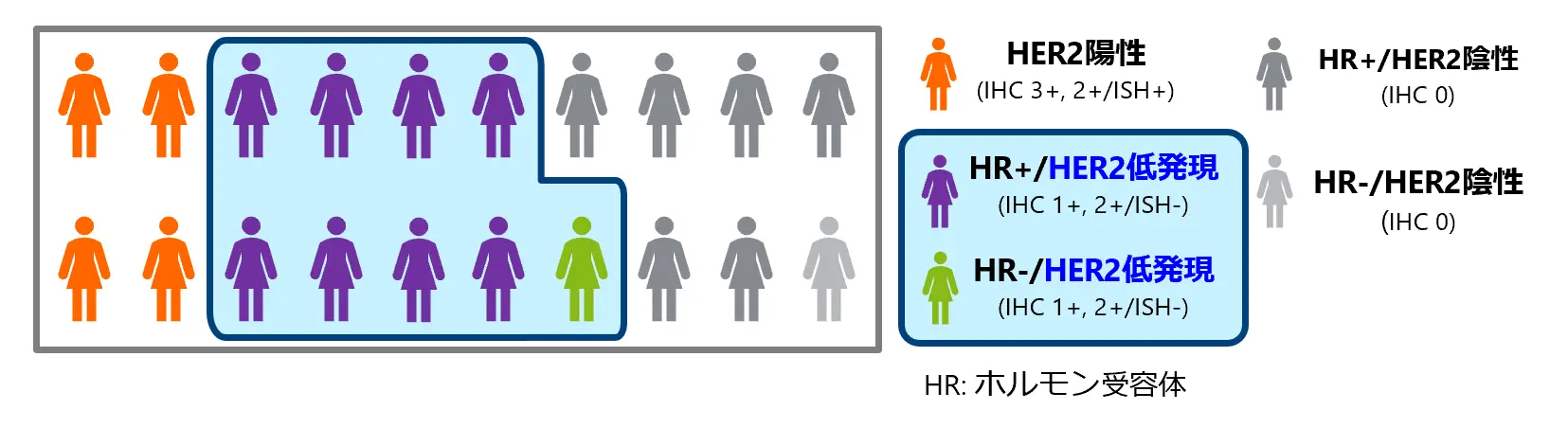
DESTINY‐Breast04試験の結果をもとに、各国・地域でHER2低発現乳がん(化学療法既治療)の適応を取得し、乳がんの標準治療に変革をもたらしました。
エンハーツ®の製品価値の最大化のため、HER2陽性乳がん及びHER2低発現乳がんの早期治療を目指し、適応拡大に向けてデータを蓄積しています。
乳がん以外でのがん種では、既に胃がん(HER2陽性胃がん2次・3次治療)、肺がん(HER2変異非小細胞肺がん2次治療)での承認を複数の国・地域で取得したほか、より早期の治療段階や、より幅広いがん腫の承認取得を目指した臨床試験を実施しています。
開発パイプライン表へのリンク:新薬開発パイプライン - 研究開発 - 第一三共株式会社 (daiichisankyo.co.jp)
■ダトロウェイ®(一般名:ダトポタマブ デルクステカン)
ダトロウェイ®は、DXd ADC技術を用いて創製したTROP2を標的とするADCです。
エンハーツ®と同様、ダトロウェイ®の価値最大化を図るためアストラゼネカとの共同開発・商業化を進めています。
■ 提携の概要
| 開発 |
|
| 販売 |
日本を除く地域 |
両社が共同販促し、損益を折半 |
| 日本 |
当社が単独販売 |
地域別の製品売上計上
・当社
日本、米国、当社が拠点を有する欧州およびその他の地域
・アストラゼネカ
中国、オーストラリア、カナダ、ロシア |
| 製造 |
・当社が製品を製造、供給
|
■受領対価
契約年月
(契約時開発ステージ) |
2020年7月
(フェーズ1) |
| 契約時一時金 |
1,100億円 |
| 開発マイルストン等(最大) |
1,100億円 |
| 販売マイルストン (最大) |
4,400億円 |
| 最大総額 |
6,600億円 |
| (1ドル=110円換算、契約締結時の為替レート水準) |
肺がんと乳がんで承認申請のための臨床試験を複数実施しています。
乳がんでは、2024年に日本、2025年に米国と欧州において、内分泌療法及び化学療法歴のあり、ホルモン受容体陽性かつHER2低発現または陰性乳がんを対象として承認を取得しました。
肺がんでは、2025年6月に米国において、EGFR標的療法及びプラチナベースの化学療法の前治療歴のある、EGFR遺伝子変異を有する非小細胞肺がんを対象とした承認を取得しました。
開発パイプライン表へのリンク:新薬開発パイプライン - 研究開発 - 第一三共株式会社 (daiichisankyo.co.jp)
■HER3-DXd、I-DXd(DS-7300)、R-DXd(DS-6000)の戦略的提携について
2023年10月、当社独自のDXd ADC技術を用いた3つの製品である HER3-DXd、I-DXd(DS-7300)及びR-DXd(DS-6000)について、Merck & Co., Inc., Rahway, NJ, USA(以下米国メルク)と全世界での開発及び商業化に向けた契約を締結しました。米国メルクは、免疫チェックポイント阻害薬「KEYTRUDA🄬」を柱にがん領域における豊富な経験、がん免疫療法に関する専門性、高い開発力を持つ世界トップクラスの会社です。当社の強みであるサイエンス&テクノロジー及びADCに関する専門性を組み合わせることにより、3製品の開発を加速し、製品価値の極大化を図ります。更に、今回の戦略的提携を契機に、開発が先行するこれらのADCに続く成長ドライバーへの迅速・柔軟なリソース配分を行い、より早く、より多くの患者さんにイノベーティブな薬をお届けする挑戦を続けています。
■ 提携の概要
| 開発 |
- 単剤・併用療法を共同開発
- 開発費用は、製品毎の20億米ドルまで米国メルクが75%を負担、それ以降は両社で折半
|
| 販売 |
日本を除く地域 |
両社が共同販促し、売上総利益と販促費等を折半 |
| 日本 |
当社が単独販売し、米国メルクにロイヤルティを支払 |
地域別の製品売上計上
当社が拠点を有する全ての国・地域(日本を含む):当社が計上
|
| 製造 |
・当社が製品を製造、供給
|
※1:HER3-DXdは契約締結から1年後、R-DXdは2年後に、契約時一時金の半額を受領予定。
※2:製品毎に20億米ドルまでの開発費について両社で折半した場合と比較して、米国メルクが当社より5億米ドル(750億円)を多く負担する(3製品共通)。
<米国メルクが当社より多く負担する5億米ドル(750億円)の受領方法>
HER3-DXd、I-DXd分:契約締結時に開発費関連一時金として受領する。(開発終了に伴い、米国メルクに一部返還される可能性あり)
R-DXd分:契約締結時に受領せず、開発費が発生する都度、受領する。
■HER3-DXd(一般名:パトリツマブ デルクステカン)
HER3-DXdは、DXd ADC技術を用いて創製したHER3を標的とするADCです。
本剤の製品価値最大化を図るため米国メルクとの共同開発・商業化を進めています。
乳がんや複数の固形がんを対象としたフェーズ2試験等が進行中です。
開発パイプライン表へのリンク:新薬開発パイプライン - 研究開発 - 第一三共株式会社 (daiichisankyo.co.jp)
■I-DXd(DS-7300)(一般名:イフィナタマブ デルクステカン)
I-DXdは、DXd ADC技術を用いて創製したB7-H3を標的とするADCです。
本剤の製品価値最大化を図るため米国メルクとの共同開発・商業化を進めています。
初期の臨床試験(フェーズ1/2試験)において、多くの前治療を受けた多様ながん種(小細胞肺がん、前立腺がん、扁平上皮食道がん、扁平上皮非小細胞肺がん など)に対し、持続的な有効性を示唆するデータを蓄積中です。
開発が先行する小細胞肺がんに加え、食道がん、前立腺がんのフェーズ3試験が進行中です。
開発パイプライン表へのリンク:新薬開発パイプライン - 研究開発 - 第一三共株式会社 (daiichisankyo.co.jp)
■R-DXd(DS-6000)(一般名:ラルドタツグ デルクステカン)
R-DXdは、DXd ADC技術を用いて創製したCDH6を標的とするADCです。
本剤の製品価値最大化を図るため米国メルクとの共同開発・商業化を進めています。
現在、プラチナ抵抗性卵巣がん2次治療以降を対象としたフェーズ2/3試験を実施中です。
開発パイプライン表へのリンク:新薬開発パイプライン - 研究開発 - 第一三共株式会社 (daiichisankyo.co.jp)
4.5DXd ADCsに続くADC
当社では、5DXd ADCsに続くDS-3939(TA-MUC1を標的とするDXd ADC)について、様々な進行性固形がん(非小細胞肺がん、乳がん、尿路上皮がん、卵巣がん、胆道がん、膵管腺がんなど)を対象としたフェーズ1/2試験を2023年9月に開始しました。
さらに、DXd ADC技術に続く、2つ目の当社独自ADC技術プラットフォームから創製されたADCである、DS-9606の臨床試験も実施しています。
(2025年5月現在)