当社は、米国サンフランシスコにて開催中の第50回米国血液学会(American Society of Hematology; ASH)年次学術集会において、現在、血栓塞栓症治療剤として開発中の経口抗Xa剤「DU-176b」の後期第Ⅱ相臨床試験データを発表いたしましたので お知らせします。
本試験は、欧米において非弁膜性心房細動(non-valvular atrial fibrillation; NVAF)を有する約1,100名の患者を対象として、主に安全性を確認する目的で実施されました。その結果、同剤の30mgおよび60mgの1日1回投 与群において、対照薬であるワルファリン投与群と臨床的に重要な出血事象の頻度は同程度であり、また主な心血管イベント等の発現において有意な差は認めら れませんでした。
なお当社は、本試験結果を踏まえ、非弁膜性心房細動を有する患者を対象とした同剤の第Ⅲ相臨床試験を開始いたしました。
*詳細については別紙をご参照願います。
(別紙)
1.DU-176bの概要
血管内での血液凝固に関与するXa因子を直接阻害する作用メカニズムを持つ経口の抗凝固剤であり、血栓塞栓症の治療および予防を目的として開発を進めている。
唯一の経口抗凝固剤とされるワルファリンと比較し、次のような特徴が期待される。
①同等の抗血栓作用を示す
②経口投与後の作用発現が速やか
③抗血栓効果と出血を助長する用量の乖離幅が大きい(広い治療域と低い出血性を示唆)
④薬効用量の個人差が小さい可能性
2.今回発表した後期第Ⅱ相臨床試験の概要
①データの公表時間
2008年12月7日 9:30(米国西海岸標準時)
②試験概要
・目的:DU-176bの非弁膜性心房細動を有する患者における安全性を確認するために、ワルファリン投与群との比較を実施
・デザイン:DU-176bの30mg、60mgの1日1回および1日2回投与群とワルファリン投与群の5群間における無作為、二重盲検比較試験(ワルファリンは非盲検)
・登録患者数:1,146名
・投与期間:12週間
③発表データの概要
・主要評価項目:出血イベント、肝機能検査値
・成績概要
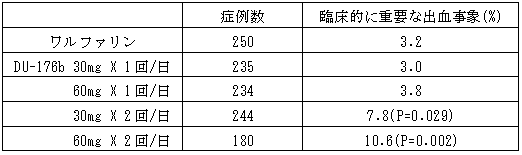
なお、肝機能異常については、各DU-176b投与群とワルファリン投与群で、有意差は認められなかった。